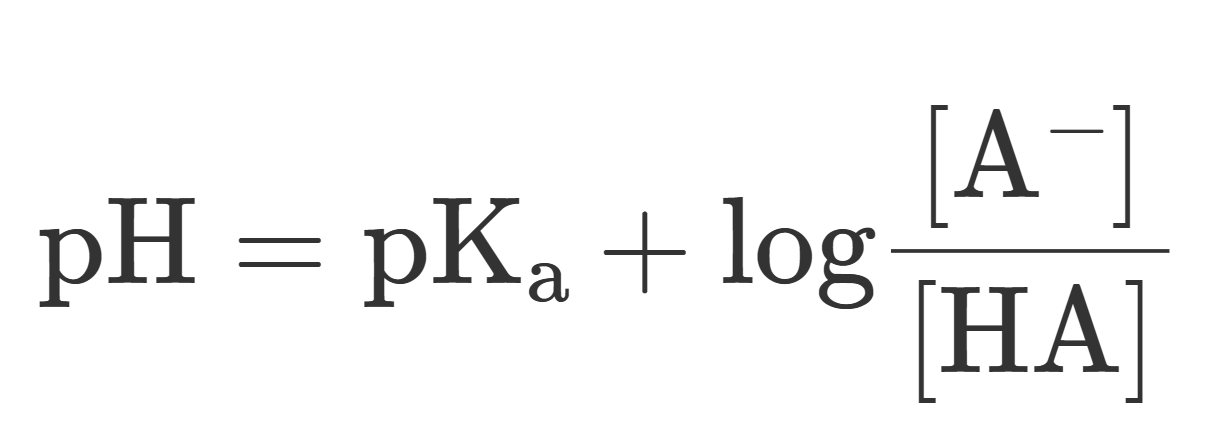この記事では, Ka(酸解離定数)を用いたpHの求め方を紹介したいと思います.つまり,ヘンダーソン・ハッセルバルヒの式の利用と導出方法の紹介です.
酸解離定数
はじめに,酢酸(CH3COOH)などのように分子1個につき,1個の水素イオン(H+)を放出する酸を一塩基酸といいます.このような一塩基酸の化学式を一般式化してHAと置きます.すると,そのHAの解離は以下の化学反応式で表すことができますね.
$$\rm{HA}+\rm{H_2O} \rightleftharpoons \rm{A^-} + \rm{H_3O^+}$$
そして,HAの解離定数(Ka)は次のように定義されます.
$$ \rm{K_a} = \frac{[H^+] [A^-]}{[HA]} $$
念のため補足しておくと,[ ] はそれぞれの濃度を示します.例えば [ HA ] は「HAの濃度」という意味になります.
確認クイズ1
ギ酸の解離定数(Ka)を表す式を書いてください.
確認クイズ1の解答例
先ほどの例にならって以下のように表すことができます.
$$ \rm{K_a} = \frac{[H^+] [HCOO^-]}{[HCOOH]} $$
酸解離定数の説明は以上になります.
酸解離指数
続いては,酸解離指数の説明ですが,本題に入る前に高校化学の内容を軽く確認しておきましょう.高校化学では,水素イオン濃度 [H+] を用いてpHを求める方法として以下の公式を学習しました.
$$ \rm{pH} = -log_{10} [H^+] $$
これを踏まえた上で本題に入りたいと思います.さて,本題の酸解離指数(pKa)ですが,何となく上のpHと似ているとは思いませんか? 実は,pKaもpHと同様にKa(酸解離定数)を用いて以下の公式で表すことができます.
$$ \rm{pK_a} = -log_{10} K_a $$
大学化学ではlog10の場合,底を省略して単にlogと書くことが多いので,それにならって以下log10の場合は底を省略します.
本当に公式までpHとそっくりですね!
確認クイズ2
酢酸の酸解離指数(pKa)を求めてください.ただし,酢酸の酸解離定数(Ka)の値は\(1.8 \times 10^{-5}\) とします.また,\(\rm{log} 1.8 \simeq 0.26\) とします.
確認クイズ2の解答例
先ほどの公式に代入するだけで簡単に求められますね.
$$ \rm{pK_a} = 5-log 1.8 =4.74 $$
酸解離定数の説明は以上になります.
ヘンダーソン・ハッセルバルヒの式を導出する
大変お待たせ致しました! ここで,本記事の本題であるヘンダーソン・ハッセルバルヒの式を導出(導出というほどでもありませんが…)したいと思います.先に結論(公式)を書きます.
$$ \rm{pH} = pK_a + log \frac{[A^-]}{[HA]} $$
このように短い式ですので,覚えるのも苦ではありませんが,前述の酸解離定数,酸解離指数の式を使うと簡単に導出することができます.以下に導出の手順を示します.
Kaの式を変形する
$$ \rm{K_a} = \frac{[H^+] [A^-]}{[HA]} $$
の式を次のように変形します.
$$ \rm{[H^+] = \frac{K_a [HA]}{[A^-]}} $$
両辺の対数をとって変形する
上の式で両辺の対数をとって変形すると,以下のようになります.
$$ \rm{pH} = pK_a + log \frac{[A^-]}{[HA]} $$
以上で導出完了になります.
まとめ・補足と確認問題
今回の記事で登場した数式をまとめます.
$$ \rm{K_a} = \frac{[H^+] [A^-]}{[HA]} $$
$$ \rm{pK_a} = -log_{10} K_a $$
$$ \rm{pH} = pK_a + log \frac{[A^-]}{[HA]} $$
補足
さて,上記でヘンダーソン・ハッセルバルヒの式を示しましたが,さらにここから近似を用いて式を変形すると緩衝液のpHを求める式を導出することができます.
弱酸HAと強塩基からなる濃度csの塩と濃度caの弱酸で構成される緩衝液のpHを求める式は,ヘンダーソン・ハッセルバルヒの式を用いて次のように近似できます.
$$ \rm{pH} \simeq pK_a + log \frac{c_s}{c_a} $$
確認問題
濃度比が1:3の酢酸と酢酸ナトリウムの混合水溶液のpHを求めてください.ただし,酢酸の酸解離指数は,4.74とします.また,必要に応じて log 2 = 0.30,log 3 = 0.48 として計算してください.
確認問題の解答例
問題文の条件より,[ca]:[cs]=1:3 であることが分かります.これをヘンダーソン・ハッセルバルヒの式の変形バージョンに代入すると,以下のようになりますね.
$$ \rm{pH} = pK_a+log \frac{[c_s]}{[c_a]} = 4.74 + log \frac{3}{1} $$
よって,log 3 = 0.48 を用いて計算すると,pH = 4.74 +0.48 = 5.22 と求めることができます.